《医疗器械临床试验质量管理规范》(食品药品监管总局令第25号)对严重不良事件(以下简称SAE)定义如下:严重不良事件是指临床试验过程中发生的导致死亡或者健康状况严重恶化,包括致命的疾病或者伤害、身体结构或者身体功能的永久性缺陷、需住院治疗或者延长住院时间、需要进行医疗或者手术介入以避免对身体结构或者身体功能造成永久性缺陷;导致胎儿窘迫、胎儿死亡或者先天性异常、先天缺损等事件。
一、案例背景:
稽查员在某研究单位核查研究者文件夹时,发现本中心上报的所有SAE未按照法规进行上报,具体问题如下:
文件夹均未保存上报给申办方所备案的食品药品监督管理部门和同级卫生计生主管部门、参与试验的其他临床试验机构和研究者、伦理委员会的回执。进一步咨询研究人员得知,本中心SAE未上报给这几个部门;
SAE上报时限不符合法规要求。
案例分享:
《医疗器械临床试验质量管理规范》(食品药品监管总局令第25号)对医疗器械SAE上报流程有明确规定:


以下流程图可直观了解医疗器械SAE的上报流程,供大家参考。
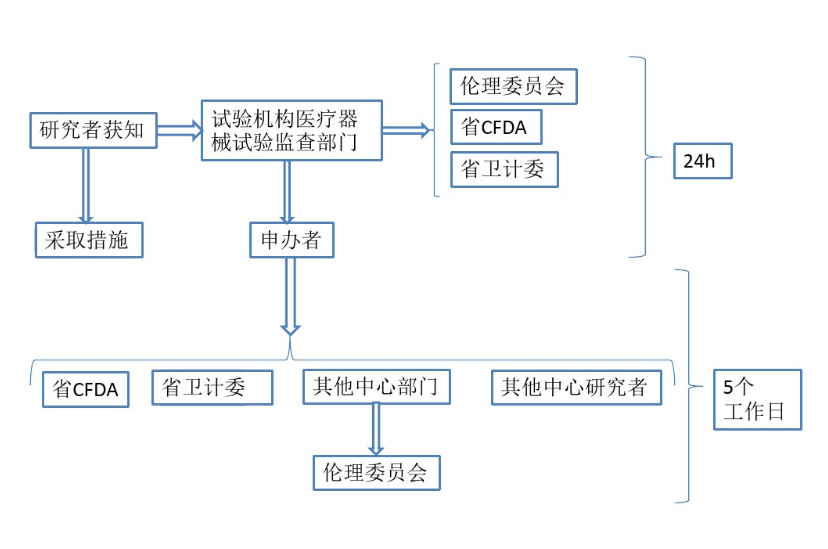
为避免研究中心出现SAE漏报部分部门、文件保存不完整情况,应提前采取相应的措施:
提前对项目组成员、研究单位人员培训上报流程;
制定项目SAE上报SOP,规定各角色人员执行要求;
配合研究者及时存档SAE上报文件(含SAE报告、上报各部门的传真回执、邮件回执、递交信回执等)至研究者文件夹;
监查员定期查看研究者文件夹,确认文件齐全。
撰写人:质量管理中心
甘燕花







