
临床试验是用于验证试验药物的临床医学、药理学以及其他药效学作用、不良反应,或者试验药物的吸收、分布、代谢和排泄等,以确定药物的疗效与安全性。通常方案设计会对合并用药、合并疾病或近期有参与其他临床试验等进行排除考虑,尽可能降低影响因素差异对试验结果的影响,受试者个体差异是影响结果的重要因素,筛选过程中会筛选一定样本量符合条件一致的受试者,尽量降低抽样误差对试验结果的影响。
案例背景:
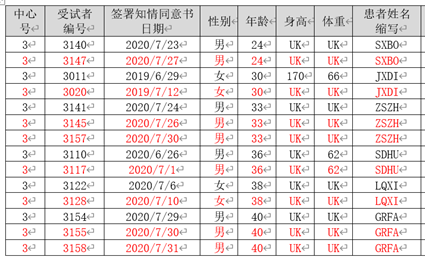
某真实世界研究项目,某研究中心出现了重复入组的情况汇总信息。如图:

案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。
案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。
案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。
案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。
案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。
案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。
案例分享:
临床试验监查过程中,发现不同患者编码出现姓名、年龄、性别、身高体重信息相同的情况。经排查,知情同意时间间隔少于排除标准规定的3个月,研究者确定为“重复入组”。
出现这种情况的原因为:
1、 研究单位的选择为非GCP单位,研究者对GCP无意识;
2、 研究者对方案设计也不够熟悉、理解也不够;
3、 监查频率不够,未能及时发现问题;
4、 在发现该问题后,未及时给予研究者正确的指引与培训,导致问题的持续存在;
总结:
以上这种情况的出现,可能会导致的问题:样本量不够,无法得到试验预想的结果;重复入组的病例有可能存在安全性的风险。对于该种情况的出现,过程中需要报备方案违背并密切关注受试者的安全性,必要时延长受试者的随访时间。同一受试者的数据具有高度相关性,临床试验通常是研究独立的样本,因此统计的处理会选取每个受试者的第一组数据进行统计分析。
在临床试验筛选研究单位和研究者时需要根据不同项目需求,以及研究者对于GCP和研究方案的认识进行针对性的培训,并书写操作规程给予培训和指导后实施临床试验,且过程中监查员也需要密切关注前面入组的病例纳入的合理性,并在过程中针对出现的问题及时采取正确的措施引导研究者按照项目操作要求进行操作。



